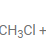REAKSI
SIKLOADISI (Reaksi Diels- Alder)
Reaksi Diels-Alder adalah reaksi kimia
organik antara diena terkonjugasi dengan alkena tersubstitusi, umumnya
dinamakan sebagai dienofil, membentuk sikloheksena tersubstitusi. Reaksi ini
dapat berjalan bahkan jika beberapa atom dari cincin yang terbentuk bukanlah
karbon. Beberapa reaksi Diels-Alder adalah reversibel; reaksi dekomposisi dari
sistem siklik dinamakan reaksi Retro-Diels-Alder. Reaksi retro ini umumnya
terlihat pada saat analisis produk reaksi Diels-Alder menggunakan spektrometri
massa
Reaksi sikloadisi adalah suatu reaksi pada
dua molekultak jenuh yang mengalami suatu reaksi adisi untukmenghasilkan
produk siklik.Dua molekul
bergabung membentuk sebuah cincin.Dalam reaksi
ini dua ikatan pi diubahmenjadi ikatansigma.Contoh reaksi sikloadisiialah
reaksi Diels-Alder.
Reaksi yang melibatkan
heteroatom juga dikenal; termasuk Reaksi aza-Diels–Alder dan Reaksi Diels–Alder imina
Reaksi Diels-Alder mungkin merupakan reaksi sikloadisi yang paling penting
dan umum diajarkan. Secara formal reaksi ini merupakan suatu reaksi sikloadisi
[4+2] dan hadir dalam berbagai bentuk, termasuk reaksi Diels-Alder heksadehidro dan trimerisasi alkuna terkait. Reaksi juga dapat berjalan dalam arah
sebaliknya seperti dalam reaksi retro-Diels–Alder.
Jenis-jenis sikloadisi
Sikloadisi
Huisgen
Reaksi sikloadisi Huisgen merupakan suatu reaksi sikloadisi (2+3).
Sikloadisi
nitron-olefin
Sikloadisi nitron-olefin merupakan
suatu reaksi sikloadisi (3+2).
Sikloadisi
olefin 2+2 dikatalisis-besi
Katalis besimpiridina(diimina)
mengandung ligan aktif
redoks dimana pusat atom besi dapat berkoordinasi dengan dua ikatan rangkap dua pada olefin sederhana
dan tidak difungsikan. Katalis dapat ditulis sebagai resonansi antara
struktur yang mengandung elektron yang tidak berpasangan dengan atom besi pusat
dalam keadaan oksidasi II, dan di mana zat besi
berada dalam keadaan oksidasi 0. Hal ini memberi fleksibilitas untuk mengikat
ikatan rangkap saat mereka menjalani reaksi siklisasi, menghasilkan struktur
siklobutana melalui eliminasi reduksi C-C; Sebagai alternatif, struktur
siklobutena dapat diproduksi dengan eliminasi beta-hidrogen. Efisiensi reaksi
bervariasi tergantung pada alkena yang digunakan, namun desain ligan yang
rasional memungkinkan perluasan kisaran reaksi yang dapat dikatalisis.
Reaksi
keletropik
Reaksi keletropik adalah
suatu subkelas sikloadisi. Fitur pembeda utama dari reaksi keletropik adalah
bahwa pada salah satu pereaksi, kedua ikatan baru dibuat pada atom yang sama.
Contoh klasiknya adalah reaksi belerang
dioksida dengan diena.
Sikloadisi formal
Sikloadisi terkadang memiliki analog dikatalisis-logam dan radikal bertahap, namun hal ini tidak secara ketat berbicara reaksi perisiklik. Bila dalam muatan siklik dibebankan atau zat antara radikal terlibat atau bila hasil siklisasi diperoleh dalam serangkaian langkah reaksi mereka terkadang disebut sebagai sikloadisi formal untuk membuat perbedaan dengan sikloadisi perisiklik sejati.
Salah satu contoh sikloadisi [3+3] formal antara enona siklik dan suatu enamina yang dikatalisis n-butillitium adalah reaksi riam enamina Stork / adisi-1,2 cascade reaction:
PERMASALAHAN !!!
1.
Apakah diena terkonjugasi dengan
konformasi s-trans dapat berubah menjadi s-cis
2.
apa yang mempengaruhi mekanisme reaksi diels
alder
DAFTAR PUSTAKA
Fessenden, Fessenden. Kimia Organik jilid 1. jakarta : erlangga.